2021-09-13
过去几年中,免疫检查点阻断疗法(Immune Checkpoint Immunotherapy, ICI)已在多种类型的肿瘤治疗中展现出显著的疗效和巨大的应用前景。Science杂志将基于T细胞的肿瘤免疫治疗誉为“2013年的年度突破”。而被称为“癌中之王”的胰腺癌却是少数几种对单药PD-1/PD-L1抗体免疫疗法不反应的肿瘤之一,其耐受的免疫学机制尚不明确。因此,阐明胰腺癌对ICI耐受的分子机制具有重要意义,并且是肿瘤免疫学和免疫治疗领域的前沿热点。
近日,天津大学生命科学学院英才副教授吕春婉联合美国佐治亚医学院Kebin Liu教授团队,在胰腺癌免疫治疗的研究中取得重要突破,在国际著名肿瘤免疫学期刊Journal for Immunotherapy of Cancer(JITC)(IF:13.751,一区)上发表题为“WDR5- H3K4me3 epigenetic axis regulates OPN expression to compensate PD- L1 function to promote pancreatic cancer immune escape”的研究论文,文中指出:抑制WDR5-H3K4me3表观遗传学通路可有效下调OPN的表达水平,阻断胰腺癌的免疫逃逸并改善抗PD-1免疫疗法在胰腺癌中的疗效。

本文要点:
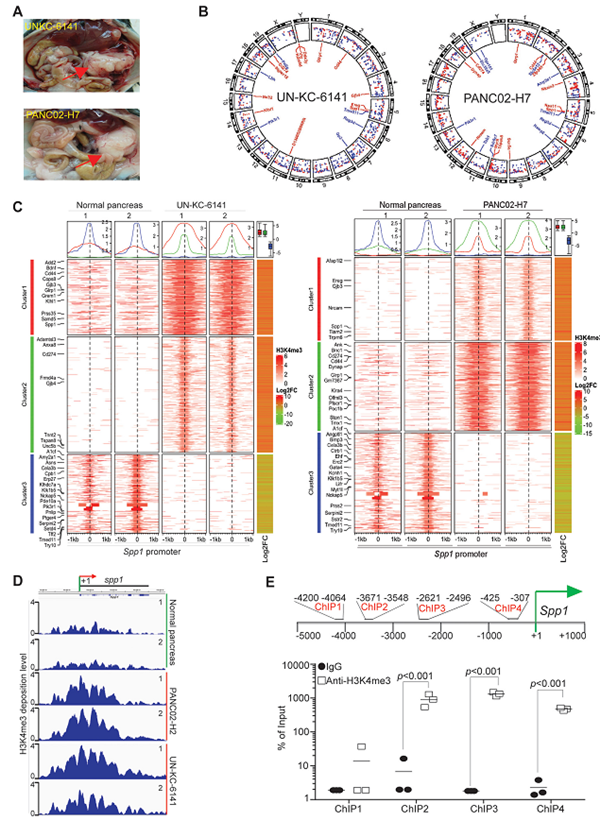
1) H3K4me3在启动子的富集程度可激活Spp1在胰腺肿瘤中的表达:对小鼠胰腺肿瘤组织的染色质免疫沉淀测序(ChIP-Seq)结果显示:H3K4me3在Spp1(编码OPN的基因)和其受体CD44启动子上高度富集。RNA测序结果显示,Spp1和CD44在两种小鼠胰腺肿瘤组织(UNKC-6141和PANC02-H7)中均高表达。
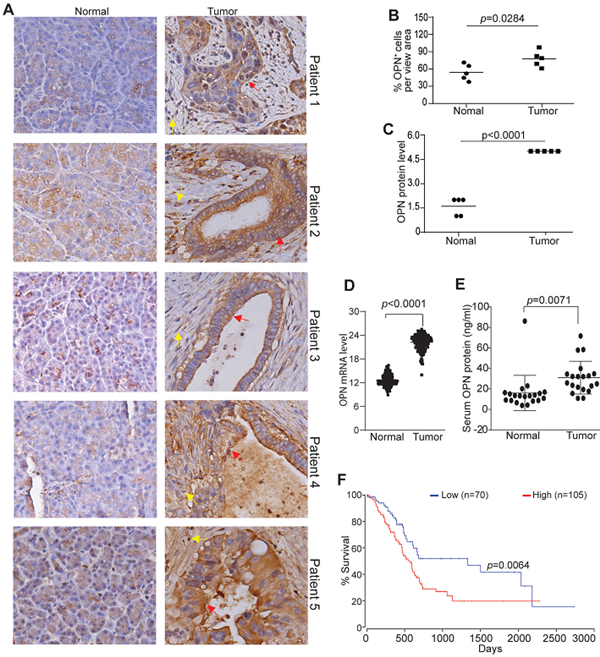
2) Osteopontin(OPN)在人胰腺癌组织中高表达,并与较差的预后相关:免疫组化检测和TCGA数据库分析均显示:OPN在人胰腺肿瘤组织中的表达水平显著高于正常胰腺组织。ELISA检测结果提示:胰腺癌病人血清中的OPN水平显著高于正常供者血清中的OPN水平。对OncoLnc数据库的分析得出:OPN表达水平与胰腺癌病人的生存时间成反相关。
3) WDR5-H3K4me3表观遗传学通路可在胰腺肿瘤细胞和髓源性抑制细胞(MDSCs)中有效调控OPN的表达并改善抗PD-1免疫疗法的疗效:WDR5是H3K4me3甲基化转移酶蛋白复合物中的重要组成部分并对酶活性起着关键的调节作用。WDR5-47, WDR5-0102和cpd23这三种WDR5小分子抑制剂可剂量依赖性地抑制MLL1-WDR5的酶活性,并可在小鼠胰腺肿瘤细胞和髓源性抑制细胞中显著降低OPN的蛋白表达水平。在小鼠原位胰腺癌模型中,WDR5-47与抗PD-1抗体合用可更加有效地抑制胰腺肿瘤在体内的生长。敲除Spp1并与抗PD-1抗体合用可得到类似的结果。

该研究工作不仅在胰腺肿瘤微环境中揭示了OPN是可以弥补PD-L1功能的新型免疫检查点,也为临床上提高ICI疗效开辟了新途径。
该论文的第一作者和共同通讯作者为天津大学生命科学学院吕春婉副教授,天津大学为本论文的第一通讯单位。本研究工作由天津大学,南昌大学和美国佐治亚医学院等多个单位合作完成。本项研究得到了国家自然科学基金项目的支持。
原文链接:https://jitc.bmj.com/content/9/7/e002624